Область хирургии, которая занимается восстановлением формы и функции тканей и органов, называется пластической, или восстановительной, хирургией. Задача пластической хирургии является устранение дефектов, которые могут быть врожденными или приобретенными, возникать вследствие повреждений, заболеваний, оперативных вмешательств и вызывать функциональные или анатомические изменения.
Еще в древней Индии для восстановления дефекта носа производили пластику кожным лоскутом на ножке, выкраивая его на лбу. Метод до сих пор носит название «индийский способ пластики носа». В Италии в XV в. появился метод пластики носа, при котором использовали кожу области плеча. Н.И. Пироговым (1852) разработана методика остеопластической ампутации стопы. В.П. Филатов (1917) предложил пересадку мигрирующего кожного стебля (филатовский стебель).
Ц. Ру и П.А. Герцен (1907) внедрили антеторакальную пластику пищевода петлей тонкой кишки. Рис.1.
В наши дни пластическая хирургия приобрела ведущее значение в хирургии, появилось новое направление в медицине — трансплантация органов и тканей. В его задачу, помимо чисто хирургических проблем, входит изучение вопросов консервации органов и тканей.
Виды пластических операций. В зависимости от источника трансплантируемых тканей или органов различают следующие виды трансплантации.
- Аутогенная трансплантация — донор и реципиент являются одним и тем же лицом.
- Изогенная трансплантация — донор и реципиент являются однояйцовыми близнецами.
- Сингенная трансплантация — донор и реципиент являются родственниками первой степени.
4. Аллоогенная трансплантация — донор и реципиент принадлежат к одному виду (пересадка от человека человеку).
5. Ксеногенная трансплантация — донор и реципиент принадлежат к разным видам (пересадка от животных человеку).
- Протезирование органов и тканей, при котором используют синтетические материалы, металлы или другие неорганические вещества.
Наиболее широкое применение получила аутопластика, а также протезирование органов и тканей. Ксенопластика (биоклапаны сердца, ксенотрансплантаты сосудов, эмбриональные ткани) используется редко из-за трудностей преодоления несовместимости тканей.
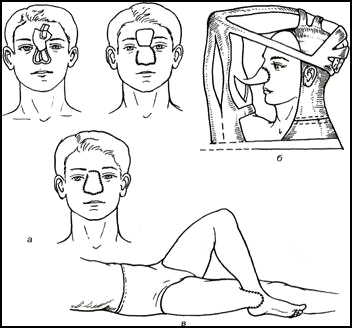
Рис. 1. Пластика кожным лоскутом на ножке «индийским» (а) и «итальянским» (б, е) методами.
Заболевания носа и околоносовых пазух
Патология органов дыхания занимает основное место в структуре заболеваемости населения Республики Саха (Якутия), а среди них воспалительные заболевания носа и околоносовых пазух. В последние годы отмечена тенденция ... скопление гноя. В таких случаях показано вскрытие гнойника с удалением омертвевших тканей и налаживанием хорошего дренирования. Операцию проводят под наркозом (кратковременным) или под ...
Виды тканевой пластики. Пересадка тканей возможна при полном отделении трансплантата от материнских тканей — свободная пластика или трансплантация. Различают следующие ее виды.
- Трансплантация тканей и органов — перемещение их с одного участка тела на другой или от одного организма другому.
- Реплантация — пораженные ткани и органы пересаживают обратно на прежнее место (скальп, оторванные конечности или их фрагменты).
- Имплантация — ткани или клетки переносят в близлежащую область.
Несвободная, связанная, или пластика на питающей ножке, предусматривает связь выкроенного тканевого лоскута с исходным ложем до тех пор, пока перемещенная часть полностью не врастет в новое место.
Кожная пластика — наиболее распространенный вид тканевой пластики. Чаще используют аутопластику кожи, ее свободный или несвободный вариант. Свободная кожная пластика имеет столетнюю историю. В 1869 г. J.L. Reverden впервые перенес несколько маленьких кусочков кожи на незаживающую гранулирующую поверхность в области локтя. Впоследствии С. Шкляровский (1870), А.С. Яценко (1871), СМ. Янович — Чайнский (1871), а также J.S. Davis (1917) подробно разработали и усовершенствовали пересадку кожи мелкими кусочками на гранулирующие поверхности ран.
Способ Яценко-Ревердена. Под местным обезболиванием скальпелем или бритвой срезают мелкие трансплантаты (тонкий слой эпидермиса) диаметром 0,3-0,5 см с наружной поверхности бедра, предплечья или передней брюшной стенки и переносят черепицеобразно на рану. На рану с трансплантатами накладывают повязку с индифферентным жиром (вазелиновое масло) на 8-10 сут. Метод применяется редко в связи с быстрым разрушением эпидермиса.
Способ Яновича- айнского-Дейвиса: трансплантаты подготавливают таким образом, чтобы они содержали все слои кожи, поскольку полнослойные трансплантаты не подвергаются аутолизу и не смещаются. Кусочки кожи укладывают в шахматном порядке на гранулирующую поверхность на расстоянии 2,5-5 мм друг от друга.
Способ Тирша. Бритвой или острым ножом отсекают полосы эпителия до верхушек сосочкового (мальпигиева) слоя шириной 2- 3 см и длиной 4-5 см. Трансплантаты лучше формировать на передней поверхности бедра. Широкими эпидермальными полосками кожи прикрывают поверхность дефекта и на 6-10 сут накладывают асептическую повязку. Этот метод позволяет добиться хороших отдаленных результатов. Он более приемлем для лечения длительно незаживающих ран и трофических язв.
Способ Лоусона-Краузе. Трансплантат больших размеров, выкроенный во всю толщу кожи, переносят на гранулирующую поверхность и фиксируют отдельными швами к краям дефекта. Недостатки метода: трансплантат, взятый во всю толщу кожи, хуже приживается, большие размеры лоскута создают трудности закрытия донорского участка.
С внедрением в клиническую практику дерматома стало возможным брать лоскут любой площади и толщины. В настоящее время с помощью электродерматомов одноэтапно можно покрыть обширные кожные дефекты (площадью до 2000 см 2 ).
Трансплантат берут под общим обезболиванием. На полученный расщепленный тонкий лоскут специальным аппаратом наносят в шахматном порядке сквозные разрезы определенной длины. При растягивании такого трансплантата можно получить поверхность с площадью, в 3-6 раз превышающей его первоначальные размеры. Так называемые сетчатые аутотрансплантаты широко применяют в камбустиологии для закрытия обширных ран .
«Теоретические основы развития творческих способностей младших ...
... технику работы с тканью на уроках технологии ГЛАВА I. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ РАЗВИТИЯ ТВОРЧЕСКИХ СПОСОБНОСТЕЙ МЛАДШИХ ШКОЛЬНИКОВ НА УРОКАХ ПРИ РАБОТЕ С ТКАНЬЮ 1.1 Психолого- педагогические особенности развития творческих способностей младших школьников на уроках технологии при работе с тканью Осуществление психолого-педагогических основ развития творческих возможностей младшего школьника требуют ...
Несвободная кожная пластика предусматривает формирование лоскута кожи и подкожной клетчатки, сохраняющего связь с материнской тканью через питающую ножку. Ножка лоскута должна быть достаточно широкой, чтобы обеспечить его хорошее кровоснабжение. Ножка не должна сдавливаться повязкой, а при перемещении лоскута следует избегать перекрута ножки вокруг продольной оси.
Местная (регионарная) кожная пластика производится с использованием окружающих тканей путем их перемещения. Рис. 2. В ряде случаев после мобилизации окружающих тканей дефект кожи можно ушить обычным способом. Послабляющие разрезы, Рис 2, II произведенные на расстоянии нескольких сантиметров от краев дефекта, позволяют сблизить края раны и наложить швы. Z-образная пластика применяется при деформации кожи грубыми рубцами для восстановления нормальных соотношений частей тела, измененных рубцовыми сращениями Рис 2, I. После иссечения рубцовых тканей выкраивают и перемещают кожные лоскуты (Рис.2, III).
Вращающийся языкообразный кожный лоскут выкраивают на участке здоровой кожи рядом с дефектом и, перемещая его, закрывают дефект (например, пластика носа по «индийскому» методу) Рис. 2, ΥΙ. Донорский участок закрывают свободным кожным лоскутом или ушивают обычным способом.
Пластика перемещением лоскута с отдаленных участков тела применяется в случаях, когда в окружности дефекта нет тканей, подходящих для формирования лоскута. Прямая пересадка кожного лоскута с отдаленных участков тела используется, если представляется возможность близко сопоставить донорский участок и место дефекта, т.е. произвести одномоментное закрытие дефекта — «итальянский» метод.
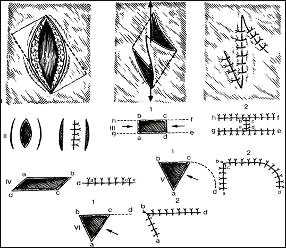
Рис. 2. Варианты закрытия дефектов кожи. Римскими цифрами обозначены виды операций, арабскими — этапы операций, латинскими буквами — ориентиры перемещений.
Мостовидная пластика, разработанная Н.В. Склифосовским, используется для пластики кожных дефектов пальцев, кисти, предплечья. Донорским участком может быть кожный лоскут на животе, в области предплечья. В области донорского участка производят 2 параллельных разреза и между ними мобилизуют участок кожи — создают «мостик», под которым помещается поврежденный фрагмент конечности (палец, предплечье) так, чтобы отслоенный лоскут покрывал дефект. Лоскут пришивают к ране. Приживление, как и при «итальянском» методе, наступает на 10-15-е сутки. В эти сроки можно отсечь лоскут от питающей ножки. Пластика мигрирующим лоскутом предусматривает формирование лоскута в отдаленных частях тела, постепенно он «транспортируется» к дефекту. Стебельчатый лоскут формируют за счет сшивания краев кожного лоскута между собой, образуя трубчатый стебель в виде рукоятки чемодана — «филатовский стебель». (Рис.3).
На передней поверхности живота производят 2 параллельных разреза до мышечной фасции, (длина кожных разрезов определяется величиной дефекта), края кожно-жирового лоскута сшивают, а место взятия лоскута зашивают. Отношение длины кожного стебля к ширине не более 3:1. Через 10-14 дней в стебель прорастают кровеносные сосуды, спустя 4 недель конец стебля отсекают, подшивают к руке и спустя 10-14 дней вшивают в место дефекта.
Реферат уход за кожей рук художественный дизайн ногтей
... уход, т.е. означает гигиеническую обработку с целью предупреждения, а также профилактики заболеваний, связанных с кожей рук, а также ногтями, а также придание рукам, ... применяли кончики натуральных ногтей, посаженных на клей. Затем в ход пошла кинопленка, одноразовые пакетики от чая, кусочки пластика., ... при котором ороговевшая кожа кутикулы обрезается. Повреждение живой ткани, которое при этом ...
Круглый мигрирующий стебель используют при пластике обширных кожных дефектов, трофических язв и незаживающих ампутационных культей, при пластике лица (создании искусственного носа, губ, закрытии «волчьей пасти»), в хирургии пищевода, глотки, трахеи, при пластике влагалища в случае его атрезии, при лечении гермафродитизма. Если по каким-либо причинам аутотрансплантацию осуществить нельзя, применяют аллотрансплантацию.
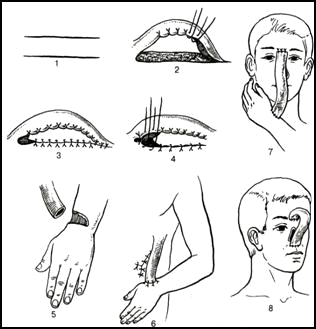
Рис. 3. Кожная пластика трубчатым кожным лоскутом («филатовский стебель»).
Аллотрансплантацию кожи используют при обширных ожогах или в случаях, когда общее тяжелое состояние больного (интоксикация, сепсис и др.) не позволяет применить ту или иную модификацию аутопластики. Свежие и консервированные кожные аллотрансплантаты применяют в ранней стадии ожоговой болезни (на 14-21-е сутки) или после иссечения некротизированных тканей. Кратковременное (на 2- 3 недели) покрытие обширной поверхности трансплантатом улучшает общее состояние больного. Нередко аутотрансплантацию комбинируют с алло — и даже ксенотрансплантацией.
Брефопластика — пересадка кожи мертворожденных плодов не старше 6 мес. При этом виде аллотрансплантации необходимо учитывать изосерологическую совместимость донора и реципиента.
В настоящее время при больших дефектах кожи все шире применяют свободную трансплантацию сегмента кожи и подкожной жировой клетчатки с сосудистым анастомозом с использованием микрохирургической техники. При этом обязательно наличие хорошо пульсирующей артерии и как минимум одной вены с достаточной дренажной емкостью, сосуды небольшого диаметра сшивают под микроскопом.
Пластика мышц. Пересадку мышц на ножке иногда используют для пломбировки костных полостей у больных хроническим остеомиелитом, при бронхиальных свищах. Регионарную мышечную пластику применяют для закрытия дефектов мускулатуры брюшной стенки, при пластике паховых грыж, грыж белой линии живота, для устранения несостоятельности заднего прохода. Пересадка мышц на ножке возможна при условии сохранения кровообращения и иннервации. Тканевые лоскуты, включающие в себя артерию, позволяют произвести замещение обширных дефектов тканей.
Свободную мышечную пластику применяют в хирургической практике для остановки кровотечения из паренхиматозных органов, пломбировки поврежденных синусов твердой мозговой оболочки.
Пластика сухожилий и фасций. Сухожилия пересаживают для восстановления утраченной функции конечности, а также функции группы парализованных мышц; при этом сухожилия соседних потенциально здоровых мышц-синергистов имплантируют в парализованные. Пластику сухожилий с наложением первичного шва производят при разрывах сухожилий. Если имеется диастаз между концами поврежденного сухожилия, применяют различные варианты местной пластики. (Рис. 4.) Свободную пластику лоскутом широкой фасции бедра применяют для укрепления капсулы сустава, замещения дефекта твердой мозговой оболочки, для формирования искусственного сфинктера прямой кишки. Возможно использование консервированных аллотрансплантатов фасций. Пластику фасцией применяют для закрытия дефектов тканей при грыжах спинного мозга и брюшной стенки.
Художественная роспись на ткани
... направление в декоративно-прикладном творчестве. Актуальность Тема моей дипломной работы - "Художественная роспись ткани". Она содержит две части: теоретическую, которая дает обоснование ... по ткани, нанося узор. Если рисунок был цветным, подготавливали несколько таких валов - для каждой краски [2]. Иногда при оформлении ткани применяли одновременно два способа украшения - переплетение нитей и роспись ...
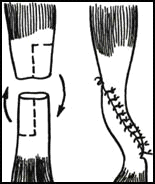

Рис. 4. Варианты пластики сухожилий
Костная пластика. Для восстановления утраченной функции и восстановления формы органа производят пересадку костей с помощью костной пластики, устраняя дефект свода черепа или челюсти, при этом восстанавливаются форма и функция органа.
Несвободная пластика впервые применена Н.И. Пироговым (1852), который осуществил остеопластическую ампутацию стопы, восстановив опорную функцию нижней конечности. Р. Гритти и Ю.К. Шимановский разработали остеопластическую ампутацию голени. Остеотомию по методу «русского замка» (Н.В. Склифосовский) используют для фиксации фрагментов кости. При трепанации черепа для закрытия дефекта тканей используют кожно-костные трансплантаты.
Свободная костная пластика применяется в виде ауто- или аллотрансплантации. Аутотрансплантация используется для фиксации костных фрагментов при замедленной консолидации переломов при ложных суставах, для заполнения костных дефектов при хроническом остеомиелите. Костные аллотрансплантаты консервируют с помощью лиофилизации или быстрого замораживания (от -70 до -196 °С).
Пересаженные аллотрансплантаты рассасываются через 2-3 года, не подавляя при этом способность кости к регенерации в зоне трансплантации. Костные аллотрансплантаты используют в качестве фиксаторов при операциях на позвоночнике, при резекции сустава или участка кости.
Пластика нервов. Целью хирургического вмешательства при повреждениях нервного ствола является сближение его концов и устранение причин, мешающих регенерации. Применение микрохирургической техники повысило эффективность пластических операций на нервах. Варианты операций на периферических нервах различны: первичный или вторичный шов; трансплантация нерва, невролиз. Первичный шов применяется во время операции — при первичной хирургической обработке раны при хорошем общем состоянии больного, отсутствии в ране размозжений тканей, при давности травмы не более 12 ч. В других случаях восстановление нерва откладывается, производят вторичное сшивание пересеченного нерва.
Перед сшиванием нерва обе его культи резецируют в пределах здоровой ткани в поперечном направлении. Швы накладывают на соединительнотканную оболочку, не прокалывая «кабели» самого нерва, используют атравматичные иглы и нити 6/0 или 7/0. При наложении эпиневрального шва следует избегать натяжения. При значительном дефекте нерва производят его трансплантацию.
Пластика сосудов. Восстановление кровоснабжения органов находит все более широкое применение. Используют ручной или механический (аппаратный) шов. Микрохирургическая сосудистая техника позволяет восстанавливать проходимость сосудов диаметром до 1 -2 мм.
В сосудистой хирургии используют аутотрансплантаты вен и артерий или синтетические протезы из дакрона, тефлона, тефлон-фторлона, политетрафторэтилена и др. Широко применяют замещение артерий аутовеной. Стенка имплантированной вены со временем уплотняется, «артериализуется», аневризмы наблюдаются очень редко. Особое значение в сосудистой пластике занимает протезирование сосудов. Сосудистые протезы используют при резекции сосудов, обходном шунтировании или для «синтетических заплат» (например, при пластике аорты).
Головной мозг человека
... на сигналы от органов чувств. У Homo sapiens, т. е. человека разумного, 80% всего объёма головного мозга приходится именно на передний отдел. Конечный мозг ... мозга. На основании головного мозга хорошо видна вторая часть среднего мозга в виде двух толстых белых расходящихся пучков, идущих в ткань полушарий большого мозга, - это ножки мозга. ... вещества. В связи с тем что здесь переключаетсябольшая часть ...
В отдельных случаях применяют консервированные аллотрансплантаты (сосуды пуповины) или ксено-трансплантаты. (Рис.5.)
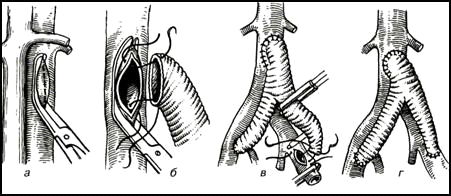
Рис.5 Протезирование сосудов, а-г — этапы операции.
- ТРАНСПЛАНТАЦИЯ ОРГАНОВ И ТКАНЕЙ
В 1957 г. советский хирург Владимир Демихов произвел невероятный эксперимент: он пересадил голову одной собаки на туловище другой и тем самым создал двуглавое животное. Подопытная собака жила пять дней и, хотя была ослаблена, все же самостоятельно держалась на ногах. При воздействии световых и звуковых раздражителей обе головы пытались лаять… (Курцмен Дж., Гордон Ф. «Да сгинет тьма»).
Биолог, физиолог, хирург-экспериментатор Владимир Петрович Демихов стал родоначальником мировой трансплантологии, его имя по праву вошло в историю мировой науки. Владимир Петрович Демихов родился 18 июля 1916 г. в России, на хуторе Кулини (территория современной Волгоградской области) в семье крестьянина. Жизненный путь определился сразу. В 1934 г. В.П. Демихов поступил в Московский государственный университет на физиологическое отделение биологического факультета и очень рано начал научную деятельность. В 1937 г., будучи студентом-третьекурсником, он сконструировал и собственными руками изготовил первое в мире искусственное сердце и вживил его собаке. Собака жила два часа.
В 1940 г. В.П. Демихов окончил университет. С самого начала и до конца войны Демихов выполняет обязанности врача-патологоанатома. Сразу после войны он приходит в Институт экспериментальной и клинической хирургии. Несмотря на трудности технического и материального порядка, энергичный и изобретательный экспериментатор производит уникальные операции. 1946 г. впервые в мире В.П. Демихов пересаживает второе донорское сердце в грудную полость, а в дальнейшем разрабатывает и апробирует в эксперименте на собаках около 40 схем пересадки сердца, в том числе и с долями легкого.
В том же году впервые в мире производит полную замену сердечно-легочного комплекса без использования аппарата искусственного кровообращения. В 1947 г. также впервые в мире он осуществляет пересадку легкого без сердца. Через год делает пересадку печени.
В 1951 г. впервые в мире заменяет сердце собаки на донорское без использования аппарата искусственного кровообращения и доказывает принципиальную возможность подобных операций. В 1952 г. впервые в эксперименте на собаках осуществляет коронарное шунтирование. Этот метод сегодня широко применяется в клинической практике во всем мире. Почти через четыре десятка лет, в 1988 г., работа отмечена Государственной премией, которую В.П. Демихов получил вместе с группой хирургов, внедрявших эту операцию в клинику. В 1956 г. Демихов пишет диссертацию на тему пересадки жизненно важных органов. В ней он анализирует результаты собственных опытов. Они были удивительны: собаки, составленные из двух половин, жили по несколько недель. Защита должна была состояться в Первом медицинском институте, но не состоялась: автора сочли фантазером, а его работу — не заслуживающей внимания. Однако подлинный ученый, уверенный в правоте своего дела, Демихов продолжал эксперименты. В 1960 г. Владимир Петрович подытожил часть своих исследований и издал первую в мире монографию по пересадке жизненно важных органов, ставшую единственным в то время руководством по трансплантологии. Его монография «Пересадка жизненно важных органов в эксперименте», изданная в Москве, была затем переиздана в Нью-Йорке, Берлине, Мадриде. В 1962 г. произошло знаменательное событие: собака прожила с двумя сердцами рекордный срок — 142 дня. И сколько бы еще прожила, неизвестно. Эксперимент был сорван чисто по-российски: пьяный больничный плотник забрался в операционную, и отреагировавший на непрошенного гостя пес получил от него удар в область пересаженного сердца.
Органы чувств человека
... быка. Вкусовые, на кислое. Язык — это мышечный орган, образованный поперечнополосатой мышечной тканью и покрыт слизистой оболочкой. При сокращении мышц ... зависят от горизонтальной и вертикальной локализации звука. Так наш мозг понимает откуда поступает звук. Этот эффект иногда используется ... момент дуть в зажатый нос. Внутреннее ухо является самым сложным из этих трех отделов органа слуха. Из-за своей ...
Развитие медицины привело к тому, что подавляющее большинство заболеваний либо излечимо полностью, либо возможно достижение длительной ремиссии. Однако имеются патологические процессы, на определенной стадии которых ни терапевтическими, ни хирургическими методами восстановить нормальную функцию органа невозможно. Трансплантация органов и тканей в последнее время приобретает все большее значение. В мире произведено более 200 000 операций по трансплантации почек, сердца, печени и поджелудочной железы. Максимальный период наблюдения после трансплантации почек превышает 25 лет, сердца — 15 лет, печени — 12 лет, поджелудочной железы — 5 лет. В нашей стране чаще производится трансплантация почек (около 7000 операций), начаты трансплантации печени и поджелудочной железы, с 1987 г. возобновлены пересадки сердца.
- ОСНОВНЫЕ ПОНЯТИЯ
ТРАНСПЛАНТОЛОГИЯ (transplantation — пересадка, англ.) наука, изучающая теоретические предпосылки и практические возможности замещения отдельных органов и тканей органами или тканями, взятыми из другого организма.
ДОНОР — человек, у которого забирают (удаляют) орган, который в последующем будет пересажен в другой организм.
РЕЦИПИЕНТ — человек, в организм которого имплантируют донорский орган.
ТРАНСПЛАНТАЦИЯ операция по замещению органа или тканей пациента соответствующими структурами, удаленными из другого организма.
Трансплантация состоит из двух этапов: забора органа из организма донора и имплантации его в организм реципиента. Она обычно производится в тех случаях, когда орган реципиента полностью разрушен в результате патологического процесса, травмы. Подобные операции производят при разрушении непарных жизненно важных органов (сердце, печень) или при аналогичных изменениях обоих парных органов (почки, легкие).
- КЛАССИФИКАЦИЯ ТРАНСПЛАНТАЦИЙ
ПО ТИПУ ТРАНСПЛАНТАТОВ
Все операции трансплантации разделяют на пересадку органов (комплексов органов): трансплантация сердца, почки, печени, поджелудочной железы, комплекса сердце — легкие и пересадку тканей и клеточных культур (пересадка костного мозга, культуры β-клеток поджелудочной железы, эндокринных желез и пр.).
ПО ТИПУ ДОНОРОВ
Литература — Патофизиология (заболевания печени)
... способствует своеобразное страение стенок печеночных синусоидов, которое не имеет свойственной капиллярам других органов базальной мембраны.Стенка построена из ... та.Глютамин с кровью транспортируется к почкам и к печени, и служит в почках в качестве субстрата для выведения ... -гепатоцит. Выведение продуктов внешней секреции печеночных кле- ток-желчи осуществляется со стороны другого - билиардного полюса ...
В зависимости от взаимоотношений между организмами донора и реципиента выделяют следующие виды трансплантаций.
Аутотрансплантация — пересадка органа в пределах одного организма (донор и реципиент одновременно одно и то же лицо).
Например, у пациента имеет место поражение устья почечной артерии, обычная реконструкция ее невозможна, а наложение обходных шунтов связано с высоким риском осложнений (при короткой артерии, раннем ее делении, атеросклерозе аорты).
Почку можно удалить, осуществить экстракорпоральную (иногда микрохирургическую) реконструкцию артерии и пересадить почку на подвздошные сосуды.
Аллотрансплантация (гомотрансплантация) пересадка между организмами одного и того же вида (от человека человеку), имеющими разный генотип. Это наиболее часто используемый вид трансплантации. Возможен забор органов у родственников реципиента, а также у других посторонних людей.
Ксенотрансплантация (гетеротрансплантация) — орган или ткань пересаживают от представителя одного вида — другому, от животного человеку, например. Метод получил крайне ограниченное применение (использование ксенокожи (кожа свиньи), клеточной культуры β-клеток поджелудочной железы свиньи).
ПО МЕСТУ ИМПЛАНТАЦИИ ОРГАНА
Все трансплантации делятся на два вида: Ортотопическая трансплантация. Донорский орган имплантируется на то же место, где находился соответствующий орган реципиента. Таким образом, осуществляют пересадку сердца, легких, печени.
Гетеротопическая трансплантация. Донорский орган имплантируют не на место нахождения органа реципиента, а в другую область. При чем неработающий орган реципиента может быть удален, или может находиться на своем типичном месте. Гетеротопическую трансплантацию производят при пересадке почки, органной пересадке поджелудочной железы. Почку, например, обычно пересаживают на подвздошные сосуды.
Операции по пересадке органов достаточно сложны, требуют специального оборудования. Но в современной трансплантологии вопросы технического выполнения операции, анестезиологического и реанимационного обеспечения принципиально решены. Сейчас трансплантологи столкнулись с проблемами обеспечения достаточного количества полноценных донорских органов и иммунологической совместимости донора и реципиента.
В подавляющем большинстве случаев в качестве живых доноров используют прямых родственников. В России не разрешено забирать для трансплантации тючку у лица, не являющегося прямым родственником реципиента. В разных странах частота пересадки почки от живого донора составляет от 5 до 40% всех трансплантаций.
При трансплантации от живого донора необходимо соблюдать следующие условия:
- иммунологическая совместимость донора и реципиента,
- донор должен быть практически здоров, что обеспечивает минимальный риск — наркоза и операции, а также хорошую функцию донорской почки в организме реципиента,
— необходимо тщательное обследование почек с применением лабораторных методов, внутривенной урографии, ультразвукового и ангиографического исследований для выявления аномалий и особенностей строения почек и их сосудов и выяснения функциональной полноценности обеих почек донора.
- ОРГАНИЗАЦИЯ ДОНОРСКОЙ СЛУЖБЫ
В крупных городах существуют центры трансплантации, при которых организованы центры забора органов. Такие центры могут быть созданы и при крупных многопрофильных стационарах. Представители центров забора контролируют ситуацию в реанимационных отделениях региона, оценивая возможность использования находящихся в критическом состоянии пациентов для забора органов. При констатации смерти мозга пациент переводится в центр трансплантации, где осуществляется изъятие органов для пересадки, или на место выезжает специальная бригада, производящая изъятие органов в стационаре, где находится пострадавший. Учитывая большую потребность в органах для пересадки, а также дефицит доноров, наблюдаемый во всех экономически развитых странах, после констатации смерти мозга обычно осуществляют комплексное изъятие органов для их максимального использования.
Система органов пищеварения
... подъязычные. 1.2. Язык Язык ( lingua ) – подвижный мышечный орган, покрытый слизистой оболочкой, богато снабженный сосудами и нервами. Язык ... приобретает форму перевернутой чаши, из нее образуется эмалевый орган. Внутри последнего на 8 неделе соединительная ткань образует ... краям языка. Последние 3 вида сосочков содержат вкусовые почки. Нижняя поверхность языка свободна от сосочков. На корне ...
- НЕЖИЗНЕСПОСОБНЫЕ ДОНОРЫ
Донорами могут быть лица от 5 до 50 лет, погибшие в реанимационном отделении в результате следующих заболеваний и состояний: изолированная черепно-мозговая травма, разрыв аневризмы сосудов мозга, некоторые заболевания головного мозга, суицидные попытки, отравление барбитуратами и некоторые другие. При этом у донора не должно быть органических заболеваний сердечно-сосудистой системы и каких-либо заболеваний или осложнений инфекционного характера. Нежизнеспособные доноры разделяются на две категории в зависимости от того, в какой период осуществляется изъятие органов. Доноры, изъятие органов и тканей у которых осуществляется после констатации смерти. Сразу после этого возможен забор для трансплантации кожи, фасции, костей и даже почки, однако чем больше времени прошло после прекращения кровообращения, тем хуже в последующем функция трансплантата.
Доноры забор органов, у которых осуществляется при работающем сердце, после констатации смерти мозга. Пересадка сердца, легких и печени, изъятых после остановки кровообращения, не производится. Эти органы необходимо забирать у донора при сохраненной работе сердца.
В законодательствах разных стран по-разному трактуются условия, при которых возможно изъятие органов для трансплантации. В России диагноз «мозговая смерть» юридически приравнен к фактической (или биологической) смерти и его постановка позволяет осуществлять забор органов для трансплантации. Для постановки диагноза мозговая смерть (смерть мозга) необходимы клинические признаки гибели мозга, а также подтверждающие это данные специальных методов исследования (электроэнцефалографии, ангиографии сосудов мозга, ультразвукового исследования, компьютерной томографии).
В России констатировать смерть мозга на основании перечисленных признаков может только специальная бригада, утвержденная соответствующими документами и состоящая из невропатолога, реаниматолога, судебного медицинского эксперта, а также официального представителя стационара, где находится пациент.
Правила забора тканей:
— изъятие органов осуществляется при строжайшем соблюдении всех правил асептики, орган изымается вместе с сосудами и протоками с максимально возможным их сохранением для удобства наложения анастомозов (почечные сосуды выкраивают вместе с участком стенки аорты и нижней полой вены и т. д.),
- после изъятия орган перфузируется специальным раствором (в настоящее время для этого используют раствор Евро-Коллинз при температуре 6-10°С),
— после изъятия орган сразу же имплантируют (если параллельно в двух операционных идут операции по забору органа у донора и доступ или удаление собственного органа — у реципиента) или помещают в специальные герметичные пакеты с раствором Евро-Коллинз и хранят при температуре 4-6°С.
Консервирование тканей и органов. Для трансплантации пригодны ткани и органы людей, погибших в результате несчастных случаев (травмы) или скоропостижно скончавшихся от различных причин (инфаркт миокарда, апоплексия мозга).
Противопоказаниями для изъятия и консервирования тканей и органов являются такие причины смерти, как отравления, СПИД, злокачественные опухоли, малярия, туберкулез, сифилис и т.п. Целесообразно у потенциального донора брать внутренние органы сразу же после констатации «смерти мозга». Ткани (кожу, сухожилия, роговицу и др.) изымают и консервируют в первые 6 ч после смерти. Изъятие тканей и органов для трансплантации производят в специальных помещениях с соблюдением правил асептики и антисептики. Взятые ткани и органы тщательно отмывают от крови и тканевой жидкости и затем консервируют, используя для этого различные методы.
- Помещение в растворы, содержащие антисептические средства или антибиотики, с последующим хранением в охлажденных растворах, в плазме или крови реципиента.
- Быстрое замораживание при температуре от -183 до -273 °С с последующим хранением при температуре от -25 до -30 °С.
- Лиофилизацию (замораживание с последующей сушкой в вакууме) применяют для консервирования костей.
- Погружение в парафин, в растворы альдегидов (формальдегид, глутаральдегид).
В специальных контейнерах ткани и органы из лаборатории доставляют в клинику, где они находятся в специальных растворах при температуре 4 °С.
- ПРОБЛЕМЫ СОВМЕСТИМОСТИ
Проблема совместимости донора и реципиента является важнейшей для обеспечения нормального функционирования трансплантата в организме реципиента. СОВМЕСТИМОСТЬ ДОНОРА И РЕЦИПИЕНТА. В настоящее время подбор донора осуществляют по двум основным системам антигенов: АВО и HLA. При трансплантации органов оптимальным является совпадение группы крови донора и реципиента по система АВО. а также и по системе Rh-фактора. Совпадение по Rh-фактору не считается обязательным. Допустимо несовпадение по системе АВО, но по следующим правилам (напоминают правило Оттенберга при гемотрансфузии):
- если у реципиента группа крови 0(I) — возможна пересадка только от донора с группой О (I),
- если у реципиента группа крови А(II) — возможна пересадка только от донора с группой А (II), с группой О(I) — нежелательно,
- если у реципиента группа крови В(III) — возможна пересадка от донора с группой 0(I) и В(III),
- если у реципиента группа крови АВ (IV) — возможна пересадка от донора с группой А(II), В(III)и AB(IV).
Совместимость по антигенам HLA является определяющей при подборе донора. Комплекс генов, контролирующих синтез основных антигенов гистосовместимости, располагается в VI хромосоме. Полиморфизм антигенов HLA весьма широк. В трансплантологии основное значение имеют локусы А. В и DR. В настоящее время идентифицировано 24 аллеля локуса HLA-A. 52 аллеля локуса HLA-B и 20 аллелей локуса HLA-DR. Комбинации генов могут быть крайне разнообразными и совпадение одновременно во всех трех указанных локусах практически невозможно. После определения генотипа (типирования) производится соответствующая запись, например: IILA-As (антиген кодируется 5 сублокусом локуса А VI хромосомы).
А 10 , B12 , B35 , DRw 6 , и т. д. Отторжение в раннем послеоперационном периоде обычно связано с несовместимостью по HLA-DR. а в отдаленные сроки — по HLA-A и HLA-B. При полном совпадении HLA-A и HLA-B вероятность приживления донорской почки в течение 2 лет составляет около 90%, при совпадении наполовину — 65-85%.
Перекрестное типирование — в присутствии комплемента проводят тестирование нескольких взятых в разное время проб сыворотки реципиента с лимфоцитами донора. Положительным считается результат, когда выявляются цитотоксичность сыворотки реципиента по отношению к лимфоцитам донора. Если хотя бы в одном случае перекрестного типирования выявлена гибель лимфоцитов донора, трансплантацию не производят.
Все реципиенты — больные, нуждающиеся в пересадке органов, проходят типирование (определяется состав антигенов системы HLA).
По его результатам, а также гематологических и клинических показателей составляют карты реципиентов, из которых формируют общую базу данных. В настоящее время в Европе действует несколько банков с данными о реципиентах (Евротрансплантат и др).
При появлении донора, у которого планируется изъятие органов, производится его нитрование по системам АВО и HLA, после чего выбирают, с каким реципиентом он наиболее совместим. Реципиента вызывают в центр трансплантации, где находится донор или куда доставляется в специальном контейнере донорская почка, и производят операцию. Пересадку почки обычно производят при совместимости по системе АВО, совпадении 2-4 антигенов по системе HLA и отрицательном результате перекрестной пробы.
- ПРОБЛЕМЫ ДОНОРСТВА
Проблема донорства является одной из важнейших в современной трансплантологии. Для подбора иммунологически совместимого донора каждому реципиенту необходимо достаточное количество доноров, отвечающих соответствующим требованиям по качеству органов, используемых для пересадки. Однако нужно помнить о том, что для донора подобная операция все-таки не является совсем безобидной: летальность при нефрэктомии составляет около 0,05%, отсутствие второй почки может сказаться при поражении единственной почки опухолью, развитии в ней конкрементов и пр. После односторонней нефрэктомии в организме донора развивается компенсаторная гипертрофия оставшейся почки, что в принципе обеспечивает вполне нормальное существование организма в последующем. Изъятие почки у живого донора возможно только при его добровольном согласии!
9. ПРОБЛЕМЫ ОТТОРЖЕНИЯ
Несмотря па предпринимаемые меры по подбору каждому реципиенту наиболее генетически близкого донора, добиться полной идентичности генотипа невозможно и у реципиентов после операции может возникнуть реакция отторжения. Отторжение встречается тем реже, чем более совместимы между собой реципиент и донор.
Выделяют сверхострое (на операционном столе), раннее острое (в течение 1 недели), острое (в течение 3 месяцев) и хроническое (отсроченное во времени) отторжение. Клинически отторжение проявляется ухудшением функции пересаженного органа и его морфологическими изменениями (по данным биопсии).
Резкое ухудшение состояния реципиента, связанное с повышением активности иммунной системы по отношению к трансплантированному органу получило название «криз отторжения». Для профилактики и лечения кризов отторжения больным после трансплантации проводится иммуносупрессивная терапия. Полное приживление тканей и органов наблюдается при аутотрансплантации, при пересадке от однояйцовых близнецов (сингенная. или изотрансплангация).
При алло- или ксеногенной пересадке развивается реакция отторжения реакция трансплантационного иммунитета.
Реакции трансплантационного иммунитета (реакция трансплантат против хозяина — РТТГХ) развивается у реципиента в течение 7-10 сут после пересадки и направлена на отторжение трансплантата. В реакции отторжения непосредственную роль играют иммуноциты, в частности Т-киллеры. но в реализации процесса участвуют макрофаги и Т-лимфоциты. В первые 4-5 сут после трансплантации происходит приживление пересаженной ткани, иммунокомпетентные клетки реципиента в этот период идентифицируют чужой антиген. С 4-5-х суток в пересаженной ткани нарушается микроциркуляция, развивается отек и начинается инвазия пересаженного органа мононуклеарными клетками; Т-лимфоциты приобретают цитотоксические свойства, а система В-лимфоцитов синтезирует антитела, в результате аллотрансплантат или ксенотрансплантат отторгается. Повторная аллотрансплантация от одного и того же донора вызывает трансплантационную иммунную реакцию в 2 раза быстрее, так как организм уже сенсибилизирован.
Современная иммунологическая концепция пересадки тканей и органов связана с взаимодействием субпопуляций Г- и В-лимфоцитов, где ведущая роль отводится субпопуляции Т-лимфоцитов (хелперным, киллерным и супрессорным клеткам).
Каждый живой организм обладает определенным иммунным статусом, оценка которого создает основу для типирования иммунной совместимости донора и реципиента. Согласно основным законам генетики, каждый индивид имеет антигены HLA-сублокуса. которые относятся к антигенам тканевой совместимости и локализуются в клеточных мембранах. Наличие нескольких SD и LD детерминант HLA- комплекса определяет трудности, с которыми приходится встречаться при подборе совместимых донора и реципиента; вероятность подбора идентичного генотипа составляет не более 1:640 000.
Для снижения активности иммунной системы и профилактики отторжения органов после операций трансплантации всем больным проводится фармакологическая иммунодепрессия. При неосложненном течении используют относительно небольшие дозы препаратов по специальным схемам. При развитии криза отторжения дозы иммунодепрессантов значительно возрастают, изменяется их комбинация. Следует помнить о том. что иммунодепрессия приводит к значительному увеличению риска инфекционных послеоперационных осложнений. Поэтому в отделениях трансплантации особенно тщательно должны соблюдаться меры асептики.
-Неспецифическая иммунодепрессия блокада иммунокомпетентной системы реципиента антимитотическими агентами (азатиоприн), глюкокортикоидами (преднизолон, урбазон) и антилимфоцитными сыворотками. В результате такого воздействия у реципиентов формируется состояние иммунодефицита и резко снижается устойчивость к инфекциям.
- Замена гематолимфоидной системы реципиента до аллотрансплантации путем тотального радиационного угнетения лимфоидной ткани с последующей пересадкой костного мозга донора.
- Селективная элиминация Т-киллерных клеток с одновременной стимуляцией активности Т-супрессорных клеток. Подобным избирательным действием характеризуется циклоспорин А.
- ЧАСТНЫЕ ВИДЫ ТРАНСПЛАНТАЦИИ
В настоящее время производятся органные трансплантации почки, сердца, легких, печени и поджелудочной железы, а также пересадка ткани эндокринных желез и клеточных культур. Наиболее важными представляются пересадки почки и сердца. Трансплантация почки является самой распространенной операцией.
Пересадка почки является самой частой операцией в трансплантологии. Она детально разработана и дает хорошие результаты. В эксперименте на животных впервые ночку пересадили Каррель и Ульман в 1902 г. В 1934 г. С.Вороновым была предпринята первая попытка трансплантации трупной почки больной при острой почечной недостаточности, закончившаяся неудачно. В настоящее время трансплантация почек является наиболее часто выполняемой операцией. Показанием к трансплантации почки является функциональная недостаточность с нарастающей уремией. Обычно почку пересаживают в гетеротопической позиции ее размещают ретроперитонеально в подвздошной ямке. Кровоток восстанавливают путем анастомозирования сосудов донорской почки с общей подвздошной артерией и веной реципиента; мочеточник имплантируют в мочевой пузырь
До операции и в ближайшем послеоперационном периоде проводят сеансы гемодиализа для уменьшения уремии. Симптомами отторжения почки служит появление лимфоцитотоксинов в крови и лимфоцитов в моче.
Трансплантация печени. Показанием к трансплантации печени является ее бурно прогрессирующая недостаточность (цирроз, злокачественные опухоли, атрезия желчных путей у новорожденных).
Печень — орган непарный, а так как её можно брать только от человека, то её заимствуют у трупа. С этим связано множество проблем, таких как подбор доноров. Есть и другие трудности: угроза кровотечения, крайняя чувствительность печени (даже 15-минуткое прекращение кровотока вызывает серьёзное повреждение печёночных клеток).
Наиболее распространённой моделью трансплантации печени является ортотопический метод, так как он создаёт для трансплантата нормальные анатомические условия, обеспечивает возможность восстановления оттока желчи в кишечник. Впервые ортотопическую пересадку печени у собаки осуществили американские учёные Ф. Мур и Т. Страцил в 1959 году. Их опыты позволили сделать вывод, что, несмотря на технические трудности и рискованность для реципиента, донорская печень способна длительно и нормально функционировать, а, кроме того, отторгаться организмом гораздо реже, чем почки, сердце и большинство других органов. Так, одна из собак прожила с пересаженной печенью 11 лет. Позднее в Денвере и Бостоне выполнили ещё 6 операций. Однако все больные погибли, не прожив и двух недель. При гетеротопической пересадке собственная печень больного сохраняется, а добавочную помещают либо в левое подреберье (селезёнка, а иногда и почка реципиента удаляются), либо в подпочечное пространство, либо в полость таза. Такая пересадка технически легче осуществима, сопровождается значительно меньшим операционным риском и не связана с резким нарушением обменных процессов. В тоже время она имеет значительные недостатки. Прежде всего, две печени в организме начинают «соперничать»… Возникает так называемая «субстратная конкуренция» между трансплантатом и собственной печенью больного. В результате одна из печеней полностью перестаёт функционировать, атрофируется и замещается соединительной тканью. Кроме того, в брюшной полости трудно найти место для второй печени, и поэтому приходиться удалять селезёнку или почку. Необходимо так же чтобы донор был гораздо меньше реципиента, и его печень была небольших размеров. Наконец ненормальное положение печени в брюшной полости приводит к лёгочным осложнениям, нарушению функции печени из-за перегибов сосудов. Развиваются тромбы, резко ухудшающие результаты трансплантации. Гетеротопическая пересадка печени впервые в эксперименте была произведена С. Уэлчем в 1955 году. Он разместил трансплантат ниже собственной печени животного. Операция прошла удачно, однако через неделю новая печень погибла, и её пришлось удалить. В клинической практике гетеротопическая пересадка печени была осуществлена 3 ноября 1964 года. Хирург из Миннеаполиса К. Апсолон пересадил 13-месячному ребёнку с грубым врождённым дефектом желчных протоков печень 2,5-летнего донора, погибшего от врождённой аномалии сердца. Трансплантат был помещён на место удалённой селезёнки. Ребёнок умер на 13-й день после операции от инфекционных осложнений, однако пересаженная печень работала нормально.
В институте трансплантологии и искусственных органов под руководством Э. Гальперина разработана методика внебрюшинной гетеротопической пересадке левой доли печени. Преимущества метода заключаются в сравнительной технической простоте операционного вмешательства и в снижении угрозы серьёзных осложнений. Он позволяет так же удалять орган при потере им функции и проводить повторную трансплантацию. Таким образом, неудачи связанные с ортотопической пересадкой, были главным образом необратимые изменения в донорской печени, которые вызваны, как правило, кислородным голоданием. Значительная трудности орто- и гетеротопических пересадок печени сопряжены с поиском подходящего донора. Высокая чувствительность печени обуславливает то, что трансплантация может быть успешной, лишь, когда орган взят у донора с ещё бьющимся сердцем, то есть гибель установлена по критерию «мозговой смерти».
Трансплантацию сердца выполняют при тяжелой сердечной недостаточности, связанной прежде всего с прогрессирующей кардиомиопатией, аневризмами левого желудочка сердца, некорригируемыми врожденными пороками сердца, к которым относятся двухкамерное сердце, атрезия правого предсердно-желудочкового (трехстворчатого) клапана и др.
Обоснованием пересадки сердца в клинике послужили экспериментальные исследования А. Карреля (1905) и В.П. Демихова (1946-1960).
А. Кантровиц в Нью-Йорке повторил подобную операцию у грудного ребенка.
Пересадка сердца была бы не осуществима без аппаратов искусственного кровообращения. Большой вклад в развитие этого направления кардиохирургии внес С.С. Брюхоненко.
С.С. Брюхоненко — автор знаменитого автожектора, первого аппарата искусственного кровообращения, без которого сегодня немыслима ни одна серьезная операция. К работе над ним он приступил в 1920 году, а уже в 1925-м состоялась первая публичная демонстрация аппарата. Все современные аппараты искусственного кровообращения, по сути, видоизмененный автожектор. Ему довелось еще при жизни ощутить результаты своего труда, что выпадает далеко не каждому ученому. Он был одним из руководителей научно-исследовательского института экспериментальной хирургии, где с помощью аппарата искусственного кровообращения профессор А.А. Вишневский в 1957 году успешно провел первую операцию на открытом сердце.
Сердце имплантируют в ортотопической позиции (на место удаленного органа) в условиях искусственного кровообращения. У реципиента оставляют заднюю стенку обоих предсердий с устьями полых вен, сохраняя таким образом зону автономной иннервации сердца. Трансплантацию начинают со сшивания задней стенки левого предсердия, межпредсердной перегородки и правого предсердия, далее соединяют аорту и легочный ствол.
Признаки отторжения сердца сначала выявляют на ЭКГ (тахикардия, экстрасистолия, уменьшение вольтажа зубцов).
Повторные эндокардиальные биопсии сердца подтверждают диагноз. Определенное значение имеет применение механического сердца. В настоящее время искусственное сердце с пневмоприводом используют для кратковременного замещения сердца при отсутствии донорского.
Реплантация оторванной конечности или ее фрагмента возможна в первые 6 ч после травмы при условии хранения оторванной конечности при температуре 4 °С, с перфузией ее сосудов перед пересадкой. После первичной хирургической обработки восстанавливают кость, затем производят пластику вены и артерии и после этого сшивают нервы, мышцы, сухожилия, фасции, кожу. В послеоперационном периоде принимают меры для предупреждения синдрома травматического токсикоза, используя гипотермию, абактериальную среду.
Трансплантация эндокринных желез. В клинике используют пересадку щитовидной железы, гипофиза, надпочечников, яичка, поджелудочной железы.
В XVIII веке английский врач Д. Гюнтер, начал изучать строение, функцию и роль желёз секреции в процессах жизнедеятельности организма. Он сделал опыт: пересадил половую железу петуха курице. Результат был поразительным: у курицы вырос гребень, а её поведение стало напоминать петушиное. Позднее основываясь на гюнтеровском опыте, учёные стали производить пересадку половых желёз, пытаясь добиться «омоложения» организма. Учёный физиолог Ш Броун — Секар проделывал следующие опыты. Считая, что старение является следствием ослабления функций желёз внутренней секреции, которые вырабатывают жизненно важные гормоны, он приготовил экстракт-вытяжку из семенных желез животных и вводил её себе. Казалось желаемый эффект достигнут: самочувствие намного улучшилось, повысилась и половая способность. Действие препарата оказалось крайне непродолжительным, а повторные впрыскивания даже ухудшали состояние здоровья. Тем не менее, ученые разных стран продолжали эксперименты. С. Воронов в 1920 году начал пересадку семенников различных животных человеку. Попадая в организм человека, они рассасывались, выделяя в окружающие ткани специфические гормоны. Но эффект и в данном случае был непродолжительным. Учёные настойчиво искали причины столь быстрого рассасывания пересаживаемых желёз, изучали влияние различных областей человеческого тела на длительность процесса. Пересаживали яичко в мышцы живота и брюшную полость, В мышцы бедра и под кожу в области молочной железы. Выяснилось, что яичко дольше не рассасывается, если его подшить в мошонку. Тем не менее, кратковременность действия пересаженных желёз породило отрицательное отношение врачей к подобным опытам.
В послевоенные годы ведущими учёными-медиками нашей страны были разработаны новые операции по пересадке яичка вместе с кровеносными сосудами, которые затем соединяли с сосудами тела, что обеспечивало нормальное питание кровью пересаженного органа, продлевало его жизнедеятельность. Впервые в мировой практике пересадка яичка на артериально — венозной ножке с применением иммунодепрессивной терапии и типированием тканей была выполнена профессором И. Кирпатовским. Взятие яичка должно производиться в строго ограниченные сроки, пока оно ещё жизнеспособно. Сохраняют его в специальном стерильном, питательном растворе до момента операции, соблюдая срок хранения. Пересадка яичек на артериально-венозной ножке обеспечивает восстановление лишь эндокринной (гормональной) функции органа. Чтобы человеку, которому пересадили половую железу, вернуть способность к деторождению, необходимо, восстановить непрерывность, путей для выброса спермы, то есть наложить сосудистые швы на семявыносящие протоки. Это, возможно, осуществить только с помощью микрохирургической техники, так как диаметр семявыводящего протока составляет 0.3 — 0.5 мм. Не смотря на ряд проблем, связанных с трансплантацией этого органа, эта операция не представляет особых трудностей и является одной из самых успешных и благополучных.
Взятие эндокринных желез для трансплантации выполняют в первые 6-10 ч после смерти. При этом выделяют сосудистую ножку железы с промыванием сосудов специальными растворами и затем замораживают при температуре -196 0 С. Чаще всего сосуды желез анастомозируют с бедренной или плечевой артерией. Функциональный эффект трансплантации проявляется отчетливо: после проведенной трансплантации яичка у мужчин исчезают заторможенность и инертность, появляется эякуляция; у женщин после пересадки яичников появляются менструации; при микседеме оказывается эффективной трансплантация щитовидной железы; тетанию, судороги устраняет пересадка паращитовидных желез; при несахарном диабете трансплантация гипофиза значительно уменьшает чувство жажды. Кроме эффективной трансплантации поджелудочной железы (тела, хвоста, долей) с сосудистым анастомозом в подвздошной ямке, гормональный эффект удалось получить при трансплантации изолированных островков Лангерганса или мельчайших фрагментов поджелудочной железы в печень через воротную вену.
Технические вопросы трансплантации органов в современных условиях решены, но абсолютный успех возможен лишь после разрешения проблемы тканевой совместимости.
Контрольные вопросы и задачи
- Различают следующие виды трансплантации:
- аутогенная;
- изогенная;
- сингенная;
- ксеногенная.
Выберите правильную комбинацию ответов:
- А) 1, 2, 3;
- Б) 1, 2, 4, 5;
- В) 1, 3, 4, 5;
- Г) 1, 4, 5;
- Д) все ответы верны.
- Определите виды свободной пластики тканей:
- трансплантация;
- реплантация;
- имплантация;
- брефопластика;
- Z-образная пластика.
Выберите правильную комбинацию ответов:
- А) 1, 2, 4;
- Б) 1, 2, 3;
- В) 1, 3, 4;
- Г) 1, 2, 5;
- Д) 1, 3, 5.
- Перечислите способы свободной кожной пластики:
- способ Яценко-Ревердена;
- способ Тирша;
- способ Филатова;
- Z-образная пластика;
- способ Лоусона-Краузе.
Выберите правильную комбинацию ответов:
- А) 1, 2, 3;
- Б) 1, 2, 4, 5;
- В) 1, 2, 3, 4;
- Г) 1, 2, 5;
- Д) все ответы верны.
Перечислите способы несвободной кожной пластики:
- мостовидная;
- способ Яновича-Чайнского-Дейвиса;
- Z-образная пластика;
- пластика мигрирующим лоскутом;
- ушивание дефекта кожи обычным способом.
Выберите правильную комбинацию ответов:
- А) 1, 2, 3;
- Б) 2, 3, 4;
- В) 1, 3, 4;
- Г) 1, 3, 4, 5;
- Д) все ответы верны.
- Методы, позволяющие повысить эффективность аллотрансплантации:
- иммунологическое типирование;
- замена гематолимфоидной системы реципиента;
- неспецифическая иммунодепрессия;
- селективная элиминация.
Выберите правильную комбинацию ответов:
- А) 1, 2, 3;
- Б) 2, 3, 4;
- В) 1, 3, 4;
- Г) все ответы верны.
Ответы: 1-Д; 2-Б; 3-Г; 4-Г; 5-Г.
пластический хирургия трансплантация
ПРИЛОЖЕНИЕ 1
ПРИКАЗ
Министерства здравоохранения РФ от 04.03.2003 № 73
Об утверждении Инструкции по определению критериев и порядка определения момента смерти человека, прекращения реанимационных мероприятий
В соответствии со статьей 46 Основ законодательства Российской Федерации об охране здоровья граждан от 22 июля 1993 г. № 5487-1 (Ведомости Съезда народных депутатов Российской Федерации и Верховного Совета Российской Федерации, 1993, № 33)
П Р И К А З Ы В А Ю:
Утвердить Инструкцию по определению критериев и порядка определения момента смерти человека, прекращения реанимационных мероприятий (приложение).
Министр Ю.Л. Шевченко
Приложение
У Т В Е Р Ж Д Е Н О
приказом Минздрава России от 04.03.2003 №73
ИНСТРУКЦИЯ ПО ОПРЕДЕЛЕНИЮ КРИТЕРИЕВ И ПОРЯДКА ОПРЕДЕЛЕНИЯ МОМЕНТА СМЕРТИ ЧЕЛОВЕКА, ПРЕКРАЩЕНИЯ РЕАНИМАЦИОННЫХ МЕРОПРИЯТИЙ. Общие сведения
— Смерть человека наступает в результате гибели организма как целого. В процессе умирания выделяют стадии: агонию, клиническую смерть, смерть мозга и биологическую смерть. Агония характеризуется прогрессивным угасанием внешних признаков жизнедеятельности организма (сознания, кровообращения, дыхания, двигательной активности).
При клинической смерти патологические изменения во всех органах и системах носят полностью обратимый характер. Смерть мозга проявляется развитием необратимых изменений в головном мозге, а в других органах и системах частично или полностью обратимых. Биологическая смерть выражается посмертными изменениями во всех органах и системах, которые носят постоянный, необратимый, трупный характер.
- Посмертные изменения имеют функциональные, инструментальные, биологические и трупные признаки:
1. Функциональные признаки: а) Отсутствие сознания. б) Отсутствие дыхания, пульса, артериального давления. в) Отсутствие рефлекторных ответов на все виды раздражителей.
2. Инструментальные признаки: а) Электроэнцефалографические. б) Ангиографические. 2.3. Биологические признаки: а) Максимальное расширение зрачков. б) Бледность и/или цианоз, и/или мраморность (пятнистость) кожных покровов. в) Снижение температуры тела. 2.4. Трупные изменения: а) Ранние признаки. б) Поздние признаки. . Констатация смерти человека
— Констатация смерти человека наступает при смерти мозга или биологической смерти человека (необратимой гибели человека).
Биологическая смерть устанавливается на основании наличия трупных изменений (ранние признаки, поздние признаки).
Диагноз смерть мозга устанавливается в учреждениях здравоохранения, имеющих необходимые условия для констатации смерти мозга. Смерть человека на основании смерти мозга устанавливается в соответствии с Инструкцией по констатации смерти человека на основании диагноза смерти мозга, утвержденной приказом Министерства здравоохранения Российской Федерации от 20,12.2001 № 460 «Об утверждении Инструкции по констатации смерти человека на основании диагноза смерти мозга» (приказ зарегистрирован Министерством юстиции Российской Федерации 17 января 2002 г. № 3170).
. Прекращение реанимационных мероприятий
- Реанимационные мероприятия прекращаются только при признании этих мер абсолютно бесперспективными или констатации биологической смерти, а именно:
- при констатации смерти человека на основании смерти головного мозга, в том числе на фоне неэффективного применения полного комплекса мероприятий, направленных на поддержание жизни;
- при неэффективности реанимационных мероприятий, направленных на восстановление жизненно важных функций в течение 30 минут.
— Реанимационные мероприятия не проводятся: а) При наличии признаков биологической смерти. б) При наступлении состояния клинической смерти на фоне прогрессирования достоверно установленных неизлечимых заболеваний или неизлечимых последствий острой травмы, несовместимой с жизнью.
ЛИТЕРАТУРА
[Электронный ресурс]//URL: https://litfac.ru/kursovaya/esteticheskaya-hirurgiya/
1) Константинов Б.А., Готье С.В. Трансплантация печени в России: проблемы, перспективы ближайшего десятилетия // Анн. хир. гепатол.-1998. — Т. 3. — №2. — С. 119-121.
Репин B.C. Трансплантация клеток: новые реальности в медицине // Бюлл. экспер. биол. и мед. — 1998. — т. 126. — приложение 1. — С. 14-28.
Репин B.C., Сухих Г.Т. Медицинская клеточная биология / М., РАМН. — 1998. — 200 с.
Сухих Г.Т. Трансплантация фетальных клеток в медицине: настоящее и будущее // Бюлл. экспер. биол. и мед. — 1998 .- Т. 126. — приложение 1.- С.3-13.
Кованов В.В.. Эксперимент в хирургии. Москва “Молодая гвардия” 1989 -240с.
Мур Ф.. История пересадок органов. Москва “Мир” 1987 — 310с.
Петришина О.Л., Цузмер А.М. Биология 9, Человек и его здоровье. Москва «Просвещение» 1999 — 240с.
