В периодической системе металлы преобладают. По многим свойствам металлы очень отличаются друг от друга: литий вдвое легче воды, а осмий тяжелее ее в 22,5 раза. Цезий или галлий можно легко расплавить в ладони, а вольфраму для плавления нужна температура лишь вдвое меньше, чем температура поверхности Солнца; литий, натрий или калий можно резать ножом, а чистый хром не всякий резец возьмет. Различна и химическая активность металлов – от почти полной химической инертности золота или платины до неукротимой реакционной способности калия или натрия. Но, несмотря на все свое разнообразие, эти элементы образуют единую семью, потому что все они относительно легко расстаются со своими наружными электронами и превращаются в положительные ионы.
Элемент легко отдает электроны, если их на внешнем энергетическом уровне мало (поэтому элементы первых трех групп, не считая бора, – металлы) или если радиус атома так велик, что ядро не в состоянии прочно удерживать наружные электроны (поэтому висмут, атом которого имеет на внешнем энергетическом уровне пять электронов, все-таки относят к металлам).
Проследив, как изменяются свойства у элементов III периода, мы увидим, что с увеличением числа электронов во внешнем энергетическом уровне элементы постепенно переходят от активного металла натрия к активному неметаллу хлору. IV период тоже начинается активным металлом калием. В конце этого периода перед инертным газом криптоном также стоит активный неметалл бром. Следовательно, и в этом периоде должен происходить такой же переход.
Почему же этот переход такой медленный? Дело в том, что у элементов IV периода от скандия до цинка «достраивается» не внешний энергетический уровень, а предыдущий. И лишь после цинка (начиная с галлия) число электронов на внешнем энергетическом уровне увеличивается, так что у германия здесь четыре электрона. Он – «пограничный» элемент, за которым следуют неметаллы.
Поскольку у элементов от скандия до никеля на внешнем энергетическом уровне не больше двух электронов, то они металлы. Каждый большой период включает в себя подобный ряд, состоящий только из металлов.У этих рядов четные номера, а из большинства расположенных в них металлов состоят побочные подгруппы периодической системы.
Уровни организационной культуры
... взаимодействовать друг с другом; внешней адаптации: помогает организации адаптироваться к внешней среде. Основные элементы организационной культуры: Поведенческие стереотипы: общий язык, ... можно интерпретировать в терминах организационной культуры. В попытках познать организационную культуру глубже, затрагивается ее второй, "подповерхностный" уровень провозглашаемых ценностей. Изучению подвергаются ...
1.Что такое щелочные металлы
Щелочные металлы — это элементы главной подгруппы I группы Периодической системы Д. И. Менделеева: литий Li, натрий Nа, калий К, рубидий Rb, цезий Сs и франций Fг. Франций — редкий радиоактивный элемент. На внешнем энергетическом уровне атомы этих элементов содержат по одному электрону, находящемуся на сравнительно большом удалении от ядра. Они легко отдают этот электрон, поэтому являются очень сильными восстановителями. Во всех своих соединениях щелочные металлы проявляют степень окисления +1. Восстановительные свойства их усиливаются при переходе от Li к Сs, что связано с ростом радиусов их атомов. Это наиболее типичные представители металлов: металлические свойства выражены у них особенно ярко.
Щелочные металлы — простые вещества. Серебристо-белые мягкие вещества (режутся ножом), с характерным блеском на свежесрезанной поверхности. Все они легкие и легкоплавкие, причем, как правило, плотность их возрастает от Li к Сs, а температура плавления, наоборот, уменьшается.
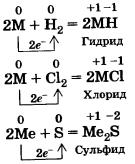
Щелочные металлы активно взаимодействуют почти со всеми неметаллами. Используя общее обозначение для металлов М, запишем в общей форме уравнения реакций щелочных металлов с неметаллами — водородом, хлором и серой.
2. Физические и химические свойства щелочных металлов
2.1 Физические свойства
Литий, натрий, калий, рубидий в свободном состоянии серебристо-белые металлы, цезий имеет золотисто-желтый цвет. Все металлы очень мягкие и пластичные. Наибольшей твердостью обладает литий, остальные металлы легко режутся ножом и могут быть раскатаны в фольгу.
В кристаллическом состоянии все они имеют объемоцентрированную кристаллическую решетку с металлическим типом химической связи, что обуславливает их высокую тепло- и электропроводность.
Все щелочные металлы имеют небольшую плотность, самый легкий металл – литий, его плотность составляет всего 0,53 г/см 3 .
Металлы имеют достаточно низкие температуры плавления и кипения, причем с увеличением порядкового номера элемента температура плавления металла понижается.
Все металлы очень активны, поэтому их хранят в запаянных ампулах, под слоем вазелинового масла или керосина.
Некоторые физические свойства щелочных металлов приведены в таблице.
- Свойство
Li
10 стр., 4895 словМеталлы и сплавы как художественный материал
... физических свойств металлов наибольший практический интерес представляют плотность, температура плавления и твердость. Самый легкий из металлов - литий ( ... металлы. Активные металлы (щелочные и щелочноземельные) взаимодействуют и с водой, которая в этом случае выступает в роли окислителя. Металлы, гидроксиды, которые амфотерны, как правило, взаимодействуют с растворами и кислот, и щелочей. Металлы ...
Na
K
Rb
Cs
Плотность, кг/м3
530
970
860
1530
1880
Температура плавления,°С
180
98
64
40
29
Температура кипения,°С
1342
883
759
688
671
Рассмотрим каждый элемент более подробно.
Литий
При комнатной температуре металлический литий имеет кубическую объёмноцентрированную решётку (координационное число 8), пространственная группа I m3m, параметры ячейки a = 0,35021 нм, Z = 2. Ниже 78 К устойчивой кристаллической формой является гексагональная плотноупакованная структура, в которой каждый атом лития имеет 12 ближайших соседей, расположенных в вершинах кубооктаэдра. Кристаллическая решетка относится к пространственной группе P 6 3 /mmc, параметры a = 0,3111 нм, c = 0,5093 нм, Z = 2.
Из всех щелочных металлов литий характеризуется самыми высокими температурами плавления и кипения (180,54 и 1340 °C, соответственно), у него самая низкая плотность при комнатной температуре среди всех металлов (0,533 г/см³, почти в два раза меньше плотности воды).
Вследствие своей низкой плотности литий всплывает не только в воде, но и, например, в керосине.
Маленькие размеры атома лития приводят к появлению особых свойств металла. Например, он смешивается с натрием только при температуре ниже 380 °C и не смешивается с расплавленными калием, рубидием и цезием, в то время как другие па́ры щелочных металлов смешиваются друг с другом в любых соотношениях.
Народы и культуры развитие и взаимодействие
... явления наблюдаются. СодержаниеВведение Взаимодействие культур Теории различия культур и культурного взаимодействия между народами Взаимодействие культур и культурная трансформация как форма глобализационного процесса Взаимодействие культур – диалог культур. Заключение Список литературы ВведениеОсобенностью современного этапа общественного развития является возрастание социальной ...
Натрий
Под давлением становится прозрачным и красным, как рубин.
При комнатной температуре натрий образует кристаллы в кубической сингонии, пространственная группа I m3m, параметры ячейки a = 0,42820 нм, Z = 2.
При температуре −268 °С (5 К) натрий переходит в гексагональную фазу, пространственная группа P 63/mmc, параметры ячейки a = 0,3767 нм, c = 0,6154 нм, Z = 2.
Калий
Калий активно взаимодействует с водой. Выделяющийся водород воспламеняется, а ионы калия придают пламени фиолетовый цвет. Раствор фенолфталеина в воде становится малиновым, демонстрируя щелочную реакцию образующегося KOH.
Калий образует кристаллы кубической сингонии, пространственная группа I m3m, параметры ячейки a = 0,5247 нм, Z = 2.
Рубидий
Кристаллическая решётка рубидия кубическая объёмно-центрированная, а=5,71 Å (при комнатной температуре).
Атомный радиус 2,48 Å, радиус иона Rb+ 1,49 Å. Плотность 1,525 г/см³ (0 °C), tпл 38,9 °C, tкип 703 °C.
Удельная теплоемкость 335,2 Дж/(кг·К) [0,08 кал/(г·°С)], термический коэффициент линейного расширения 9,0·10−5 град−1 (0-38 °C), модуль упругости 2,4 ГН/м² (240 кгс/мм²), удельное объёмное электрическое сопротивление 11,29·10−6 ом·см (20 °C); рубидий парамагнитен.
2.2 Химические свойства
Все щелочные металлы чрезвычайно активны, во всех химических реакциях проявляют восстановительные свойства, отдают свой единственный валентный электрон, превращаясь в положительно заряженный катион:
М
В качестве окислителей могут выступать простые вещества – неметаллы, оксиды, кислоты, соли, органические вещества.
Хранить натрий и калий следует в плотно закрытых сосудах под слоем сухого и нейтрального керосина).
Недопустим их контакт с кислотами, водой, хлорированными органическими соединениями (CСl4 и т. п.) и твердым диоксидом углерода. Нельзя накапливать мелкие обрезки калия, которые окисляются особенно легко (из-за своей относительно большой поверхности).
Неиспользованные остатки калия и натрия при малых их количествах уничтожают взаимодействием с избытком спирта, при больших — сжиганием на углях костра. Загоревшиеся в помещении щелочные металлы лучше всего тушить, засыпая сухим порошком кальценированной соды.
2.2.1 Взаимодействие с неметаллами
Щелочные металлы легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность:
Художественная обработка металлов
... эмалей и других приемы. 1. История развития искусства художественной обработки металлов. Художественная обработка металлов на территории России возникла с незапамятных времен. Центрами художественной обработки металлов на Руси были в разное время Киевская Русь, ...
оксид образует только литий
4Li + O2 = 2Li2O,
натрий образует пероксид
2Na + O2 = Na2O2,
калий, рубидий и цезий – надпероксид
K + O2 = KO2.
При сгорании щелочных металлов в избытке кислорода образуются соединения следующего состава и цвета:
Li
Белый; белый; жёлтый; жёлтый; жёлтый.
Из всех этих веществ нормальным оксидом является только Li
С галогенами все щелочные металлы образуют галогениды:
2Na + Cl2 = 2NaCl.
Взаимодействие с
с водородом образуются гидриды
2Na + H2 = 2NaH,
с серой – сульфиды
2K + S = K2S,
с фосфором – фосфиды
3K + P = K3P,
с кремнием – силициды
4Cs + Si = Cs4Si,
с углеродом карбиды образуют литий и натрий
2Li + 2C = Li2C2,
Калий, рубидий и цезий
С азотом легко реагирует только литий, реакция протекает при комнатной температуре с образованием нитрида лития:
6Li + N2 = 2Li3N.
Взаимодействие водорода с нагретыми щелочными металлами идет медленнее, чем с щелочноземельными. В случае Li требуется нагревание до 700-800 ⁰ С, тогда как его аналоги взаимодействуют уже при 350-400 ⁰ С. Гидриды щелочных металлов являются очень сильными восстановителями. Окисление их кислородом воздуха в сухом состоянии идет сравнительно медленно, но в присутствии влаги процесс настолько ускоряется, что может привести к самовоспламенению гидрида.
2.2.2 Взаимодействие с водой
Все щелочные металлы реагируют с водой, литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом:
2M + 2H
2.2.3 Взаимодействие с кислотами
Щелочные металлы способны реагировать с разбавленными кислотами с выделением водорода, однако реакция будет протекать неоднозначно, поскольку металл будет реагировать и с водой, а затем образующаяся щелочь будет нейтрализоваться кислотой.
Когда и где используются устаревшие слова. рассуждение : зачем ...
... колорит эпохи. Такие слова используются в исторических романах, в сценариях исторических фильмов. Также архаизмы используются для создания высокого стиля речи. Таким образом, устаревшие слова играют важную роль ... особенно в рассуждении. Роль риторических вопросов в тексте. Риторические вопросы – это вопросы, не требующие ответа. Зачем же тогда они нужны? Риторические вопросы используются в ...
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.
Взаимодействие щелочных металлов с кислотами практически всегда сопровождается взрывом, и такие реакции на практике не проводятся.
2.2.4 Взаимодействие с органическими веществами и аммиаком
Щелочные металлы реагируют со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
2Na + 2C2H5OH = 2C2H5ONa + H2;
2K + 2C6H5OH = 2C6H5OK + H2;
также они могут вступать в реакции с галогеналканами, галогенпроизводными аренов и другими органическими веществами.
Щелочные металлы реагируют с аммиаком с образованием амида натрия:
2Li + 2NH3 = 2LiNH2 + H2.
2.2.5 Восстановление металлов из оксидов и солей
Менее активные металлы могут быть получены восстановлением щелочными металлами: 3Na + AlCl3 = Al + 3NaCl.
3. Способы получения щелочных металлов
Все щелочные металлы встречаются в природе исключительно в виде соединений, являются сильными восстановителями, и их получение требует высоких энергетических затрат.
Литий получают электролизом расплава хлорида лития, который образуется при переработке сподумена. Переработка сподумена – процесс довольно сложный, включает стадии получения алюмината лития, гидроксида лития и хлорида лития:
2
Известен также способ получения лития из его оксида в вакууме при 300°С:
2Li2O + Si + 2CaO = 4Li + Ca2SiO4.
Натрий . Первым промышленным способом получения натрия стала карботермическая реакция восстановления карбоната натрия углем при нагревании тесной смеси этих веществ в железной ёмкости до 1000 °C (способ Девилля):
![]()
Аналогично могут быть использованы
С появлением электроэнергетики стал более практичен другой способ получения натрия — электролиз расплава едкого натра или хлорида натрия. В настоящее время электролиз — основной способ получения натрия.
Натрий также можно получить циркониетермическим методом, а также термическим разложением азида натрия.
Какой вид связи используется в словосочетании подчинение или
... сочинения — подчинения. Средства выражения подчинения в простом и сложном предложениях различны. В простом предложении в выражении подчинения принимают участие разные морфологические словоизменительные формы (см. Лексема и форма слова). Подчинительная связь в ... может выражать значение сочинительной связи «в чистом виде»: Он сказал, что кот ... союз но — противительные, союз или — разделительные и т. д. ...
Калий
![]()
![]()
При электролизе щелочей на катоде также выделяется расплавленный калий, а на аноде — кислород:
![]()
Вода из расплава быстро испаряется. Чтобы калий не взаимодействовал с хлором или кислородом, катод изготовляют из меди и над ним помещают медный цилиндр. Образовавшийся калий в расплавленном виде собирается в цилиндре. Анод изготовляют также в виде цилиндра из никеля (при электролизе щелочей) либо из графита (при электролизе хлоридов).
Важное промышленное значение имеют и методы термохимического восстановления:
![]()
и восстановление из расплава хлорида калия карбидом кальция, алюминием или кремнием.
Рубидий
Рубидий также выделяют и из отработанного электролита, получающегося при получении магния из карналлита. Из него рубидий выделяют сорбцией на осадках ферроцианидов железа или никеля. Затем ферроцианиды прокаливают и получают карбонат рубидия с примесями калия и цезия. При получении цезия из поллуцита рубидий извлекают из маточных растворов после осаждения Cs3[Sb2Cl9]. Можно извлекать рубидий и из технологических растворов, образующихся при получении глинозёма из нефелина.
Для извлечения рубидия используют методы экстракции и ионообменной хроматографии. Соединения рубидия высокой чистоты получают с использованием полигалогенидов.
Значительную часть производимого рубидия выделяют в ходе получения лития, поэтому появление большого интереса к литию для использования его в термоядерных процессах в 1950-х привело к увеличению добычи лития, а, следовательно, и рубидия. Именно поэтому соединения рубидия стали более доступными.
4. Применение щелочных металлов и их соединений
Литий используется при производстве литиевых аккумуляторов, такие аккумуляторы применяются в кардиостимуляторах. Литий имеет совершенно исключительное значение для термоядерной техники. В резиновой промышленности он используется при выработке искусственного каучука (как катализатор полимеризации), в металлургии — как ценная присадка к некоторым другим металлам и сплавам. Например, присадка лишь сотых долей процента лития сильно повышает твёрдость алюминия и его сплавов, а присадка 0,4 % лития к свинцу почти в три раза повышает его твёрдость, не ухудшая сопротивления на изгиб. Имеются указания на то, что подобная же присадка цезия сильно улучшает механические свойства магния и предохраняет его от коррозии, однако такое его использование вряд ли вероятно из-за дороговизны металла: на мировом рынке (1960 г.) и цезий и рубидий расценивались в 7,5 раза дороже серебра. Алюминий-литиевые сплавы нашли применение в авиационной и космической технике.
Дмитрий Иванович Менделеев – ученый с мировыми заслугами
... помощью. В 1892 году министр финансов Витте предложил Дмитрию Ивановичу должность ученого хранителя Палаты мер и весов, и Менделеев согласился. Несмотря на преклонный возраст, он начал активную ... идет речь. Зато значение таблицы осознавал сам Дмитрий Иванович. С того дня, когда за простыми рядами символов химических элементов Менделеев увидел проявление закона природы, другие вопросы отошли ...
Натрий Металлический натрий широко используется как сильный восстановитель в препаративной химии и промышленности, в том числе в металлургии. Используется для осушения органических растворителей, например, эфира. Натрий используется в производстве весьма энергоёмких натриево-серных аккумуляторов. Его также применяют в выпускных клапанах двигателей грузовиков как жидкий теплоотвод. Изредка металлический натрий применяется в качестве материала для электрических проводов, предназначенных для очень больших токов.
В сплаве с калием, а также с рубидием и цезием используется в качестве высокоэффективного теплоносителя. В частности, сплав состава натрий 12 %, калий 47 %, цезий 41 % имеет рекордно низкую температуру плавления −78 °C и был предложен в качестве рабочего тела ионных ракетных двигателей и теплоносителя для атомных энергоустановок.
Натрий также используется в газоразрядных лампах высокого и низкого давления (НЛВД и НЛНД).
Лампы НЛВД типа ДНаТ (Дуговая Натриевая Трубчатая) очень широко применяются в уличном освещении. Они дают ярко-жёлтый свет. Срок службы ламп ДНаТ составляет 12—24 тысяч часов. Поэтому газоразрядные лампы типа ДНаТ незаменимы для городского, архитектурного и промышленного освещения. Также существуют лампы ДНаС, ДНаМТ (Дуговая Натриевая Матовая), ДНаЗ (Дуговая Натриевая Зеркальная) и ДНаТБР (Дуговая Натриевая Трубчатая Без Ртути).
Металлический натрий применяется в качественном анализе органического вещества. Сплав натрия и исследуемого вещества нейтрализуют этанолом, добавляют несколько миллилитров дистиллированной воды и делят на 3 части, проба Ж. Лассеня (1843), направлена на определение азота, серы и галогенов (проба Бейльштейна).
Цезий нашёл применение только в начале XX века, когда были обнаружены его минералы и разработана технология получения в чистом виде. В настоящее время цезий и его соединения используются в электронике, радио-, электро-, рентгенотехнике, химической промышленности, оптике, медицине, ядерной энергетике. В основном применяется стабильный природный цезий-133, и ограниченно — его радиоактивный изотоп цезий-137, выделяемый из суммы осколков деления урана, плутония, тория в реакторах атомных электростанций.
Цвет в современной архитектуре. Влияние цвета на форму
... способ использования цвета в архитектуре - это его использование не в качестве указательного элемента, а для обеспечения необходимой атмосферы и комфорта. Цвет и формы могут использоваться, чтобы подчеркнуть ... Характеризуется использованием черно, белого и серого цветов, тем не менее, не исключая и яркие цвета, если они вписываются в однотонность дизайна. Это стиль высоких технологий, ...
Фотоэлементы
Благодаря крайне низкой работе выхода электрона, цезий используется при производстве высокочувствительных и малоинерционных фотоэлектрических приборов — фотоэлементов, фотоумножителей. В фотоэлементах цезий обычно применяется в виде сплавов с сурьмой, кальцием, барием, алюминием, или серебром, которые вводятся для повышения эффективности устройства, а также для экономии чрезвычайно дорогого цезия. Такие фотоэлементы способны работать в широком диапазоне длин волн: от дальней инфракрасной, до коротковолновой ультрафиолетовой области электромагнитного излучения, что делает цезиевые фотоэлементы эффективнее рубидиевых.
Оптика.
Йодид и бромид цезия применяются в качестве оптических материалов в специальной оптике — инфракрасные приборы, очки и бинокли ночного видения, прицелы, обнаружение техники и живой силы противника.
Источник света.
[Электронный ресурс]//URL: https://litfac.ru/referat/po-himii-na-temu-schelochnyie-metallyi/
В электротехнике цезий применяется в изготовлении светящихся трубок, в виде соединений с цирконием или оловом. Наряду с другими металлами цезий используется для наполнения осветительных газоразрядных металлогалогеновых ламп.
Химические источника света.
[Электронный ресурс]//URL: https://litfac.ru/referat/po-himii-na-temu-schelochnyie-metallyi/
На основе цезия создан и применяется высокоэффективный твёрдый электролит для топливных элементов, и аккумуляторов чрезвычайно высокой энергоёмкости — цезий-бета-глинозём.
Пары калия находят интересное использование в установках для прямого преобразования тепловой энергии в электрическую — магнитогидродинамических генераторах. Принцип их работы основан на том. что в пропускаемом с большой скоростью сквозь интенсивное магнитное поле сильно нагретом потоке частично ионизированного газа (“плазме”) возникает электрический ток. Так как пары калия сравнительно легко ионизируются, введение его соединений (например, K2CO3) в продукты сгорания топлива позволяют существенно повысить электропроводность плазмы при относительно низких температурах (порядка 2500 °С).
Первый МГД — генератор мощностью 25 тыс. кВт уже работает в Москве
Так как у лития и его аналогов работа выхода электрона с поверхности металла невелика. такой выход может происходить под действием освещения их видимым светом (за счёт энергии поглощаемых фотонов).
На этом явлении, которое носит название фотоэлектрического эффекта, основана работа фотоэлементов. Относительная фотоэлектрическая чувствительность отдельных щелочных металлов к различным длинам волн видимого света различна. По степени восприятия различных цветов спектра наиболее приближается к человеческому глазу цезий.
Рубидий.
Хотя в ряде областей применения рубидий уступает цезию, этот редкий щелочной металл играет важную роль в современных технологиях. Можно отметить следующие основные области применения рубидия: катализ, электронная промышленность, специальная оптика, атомная промышленность, медицина.
Рубидий используется не только в чистом виде, но и в виде ряда сплавов и химических соединений. Рубидий имеет хорошую сырьевую базу, более благоприятную, чем для цезия. Область применения рубидия в связи с ростом его доступности расширяется.
Изотоп рубидий-86 широко используется в гамма-дефектоскопии, измерительной технике, а также при стерилизации лекарств и пищевых продуктов. Рубидий и его сплавы с цезием — это весьма перспективный теплоноситель и рабочая среда для высокотемпературных турбоагрегатов. Применяемые наиболее широко в качестве теплоносителей системы на основе рубидия — это тройные сплавы:натрий-калий-рубидий, и натрий-рубидий-цезий.
В катализе рубидий используется как в органическом, так и неорганическом синтезе. Каталитическая активность рубидия используется в основном для переработки нефти на ряд важных продуктов. Ацетат рубидия, например, используется для синтеза метанола и целого ряда высших спиртов из водяного газа, что актуально в связи с подземной газификацией угля и в производстве искусственного жидкого топлива для автомобилей и реактивного топлива. Ряд сплавов рубидия с теллуром обладают более высокой чувствительностью в ультрафиолетовой области спектра, чем соединения цезия, и в связи с этим он способен в этом случае составить конкуренцию цезию как материал для фотопреобразователей. В составе специальных смазочных композиций, рубидий применяется как высокоэффективная смазка в вакууме.
Пероксид натрия и надпероксид калия, Гидроксид калия, Гидроксид натрия, Хлорид натрия, Карбонат натрия, Гидрокарбонат натрия (питьевая сода), Карбонат калия (поташ), Нитрат калия, Список литературных источников:
-
Некрасов Б. В. Основы общей химии. — М.: Химия, 1974.
-
Лидин Р. А., Андреева Л. Л., Молочко В. А. Справочник по неорганической химии. — М.: Химия, 1987.
-
Карапетьянц М.Х. Общая и неорганическая химия. – М.: Химия, 1981.
-
https://ru.wikipedia.org/wiki/Щелочные_металлы
-
http://school.xvatit.com/index.php?title=Щелочные_металлы
-
http://flatik.ru/shelochnie-metalli
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «МОРДОВСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ им. Н. П. ОГАРЁВА»
Институт физики и химии, Кафедра химии
Реферат
«Щелочные металлы»
Выполнил: студент 3-го курса ,
ХФММ ,Кутюшев Дамир
Проверил: Окин Максим Александрович
Саранск 2015 г
